实验七、pH计的使用及溶液pH的测定
一、实验目的
1、熟悉pH计的构造及测定原理。
2、掌握用pH计测定溶液pH的步骤。
二、实验原理
1、pH电极的构造:
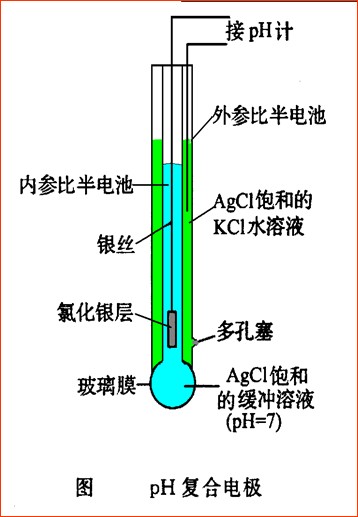
2、玻璃电极使用前,必须在水溶液中浸泡,使之生成一个三层结构,即中间的干玻璃层和两边的水化硅胶层。浸泡后的玻璃膜示意图:
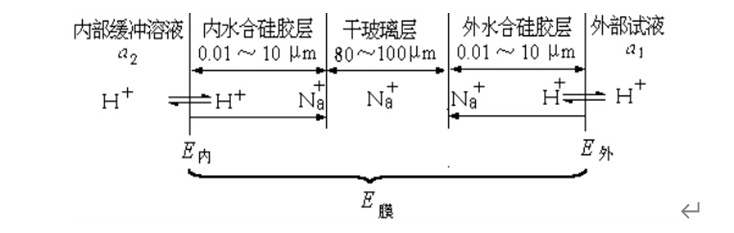
(1)水化硅胶层具有界面,构成单独的一相,厚度一般为0.01~10 µm。在水化层,玻璃上的Na+与H+发生离子交换而产生相界电位,也即道南电位。
(2)水化层表面可视作阳离子交换剂。溶液中H+经水化层扩散至干玻璃层,干玻璃层的阳离子向外扩散以补偿溶出的离子,离子的相对移动产生扩散电位。两者之和构成膜电位。
(3)将浸泡后的玻璃电极放入待测溶液,水合硅胶层表面与溶液中的H+活度不同,形成活度差,H+由活度大的一方向活度小的一方迁移,平衡时:
H+(溶液)=H+(硅胶)
E内=k1+0.059lg(a2/a2')
E外=k2+0.059lg(a1/a1')
a1、a2分别表示外部试液和电极内参比溶液的H+活度;a1'、a2'分别表示玻璃膜外、内水合硅胶层表面的H+活度;k1、k2则是由玻璃膜外、内表面性质决定的常数。
(4)由于玻璃膜内、外表面的性质基本相同,则k1=k2,a1'=a2'
E膜=E外-E内=0.059lg(a1/a2)
(5)由于内参比溶液中的H+活度(a2)是固定的,则:
E膜=K' +0.059lga1=K' -0.059pH(试液)

3、用电位法测定溶液的pH值时,E(电池) = K + 0.059 pH。由于K是无法测量的,我们可以利用在相同条件下测pH值与之相近的标准缓冲溶液Es = K + 0.059 pH,通过两式来消除K,从而求得pHx = pHs +(Es-Ex)/0.0592 V
水质监测是水质分析的常规项目。本实验通过监测昆明湖水、自来水等不同水质的pH值,学习pH计的使用及其样品处理,水质评价。
三、实验仪器及试剂
仪器:pHS-3C+酸度计。
试剂:标准溶液(混合磷酸盐pH = 6.86、邻苯二酸氢钾pH = 4.00、硼砂pH = 9.18),未知液1、2和湖水。
四、实验步骤
1、打开电源,按“pH/mV”,进入pH测定状态,按“温度”按钮,使显示溶液温度值,然后按“确认”键,仪器确定溶液温度后回到pH测量状态。
2、用超纯水清洗酸度计电极,并用滤纸将水吸干。
3、校准pH计(三点法):将电极插入到pH = 6.86的缓冲溶液中,待读数稳定后按“定位”键,(pH指示灯慢闪烁,表明仪器在定位标定状态),调节读数为该溶液当时温度下的pH值,然后按“确认”键,仪器进入pH测定状态,pH指示灯停止闪烁。然后再依次用pH = 4.00和pH = 9.18的缓冲液进行校正。
4、清洗电极,将电极插入未知液中测量其pH值,每组平行测量三次。
5、样品处理测定
将电极浸入水样中,搅拌溶液,测量其pH值,每组平行测量三次。
6、测量完毕,清洗电极,将电极插入到饱和KCl溶液中保护,关闭电源。
五、实验数据记录及处理
分别在室温及T=25℃时测定
待测溶液 |
测量温度 |
数据 |
平均值 |
未知液1 |
|
|
|
|
|
未知液2 |
|
|
|
|
|
湖水 |
|
|
|
|
|
六、实验注意事项
1、用搅拌磁子搅拌。
2、建议使用温度补偿探头进行温度补偿。
3、选择与样品pH值接近的缓冲液校准仪器。
4、pH电极不用时浸泡在饱和KCl溶液中。
5、用于校准仪器的标准液用完回收,不能丢弃。
七、思考题
1. 当温度高于或低于25℃时,会对pH测量产生何种影响?
2. 对湖水等复杂水样测量时存在的响应时间较慢的现象,试分析可能的原因?
附表:(自行查阅)
不同温度下标准缓冲溶液的温度和pH关系曲线图。
标准缓冲溶液的配置及常见的标准缓冲溶液
试根据实验感受,查阅资料设计湖水等复杂水样的前处理方法