实验六、离子选择电极法测定水体中氟离子的含量
一、实验目的
1、了解氟离子选择电极的构造及测定自来水中氟离子的实验条件。
2、掌握离子计的使用方法。
二、实验原理
氟离子选择电极是目前最成熟的一种离子选择电极。将氟化镧单晶封在塑料管的一端,管内装0.1 mol/L NaF和0.1 mol/L NaCl溶液,以Ag-AgCl电极为参比电极,构成氟离子选择电极(其结构如下图所示)。
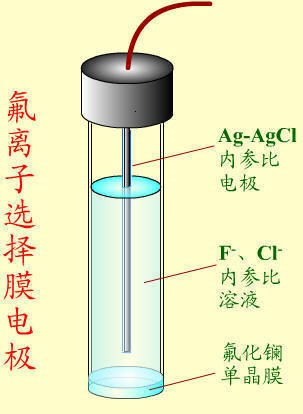
用氟离子选择电极测定水样时,以氟离子选择电极作工作电极,以饱和甘汞电极作为参比电极,组成的测量电池为:氟离子选择电极︱试液 ‖ SCE
如果忽略液接电位,电池的电动势为:

即电池的电动势与试液中氟离子活度的对数成正比,氟离子选择电极对氟离子的线性响应范围一般在1.0 × 10-1 ~ 1.0 × 10-6 moL/L范围。
1、氟离子选择电极具有较好的选择性,干扰主要有:
阴离子: OH- (LaF3 + 3OH- = La(OH)3 + 3F- )
阳离子: Fe3+、Al3+、Sn(Ⅳ) ( 易与F-形成稳定配位离子)
2、氟离子选择电极法测定的是溶液中离子的活度,因此,必须加入大量支持电解质(如NaCl)以控制试液的离子强度。
3、用总离子强度调节缓冲液控制试液pH和离子强度以及消除干扰。通常用乙酸缓冲溶液控制溶液的pH。用柠檬酸钠进行掩蔽。
三、实验仪器与试剂
仪器:离子计或pH计,氟离子选择电极,饱和甘汞电极,电磁搅拌器,容量瓶(100 mL 7只),烧杯(100 mL 6个),10 mL移液管(2个),50 mL移液管(2个)。
试剂:F-标准溶液(0.1000 mol/L),自来水样,离子强度调节缓冲液(TISAB)。
四、实验步骤
1、氟离子选择电极的准备
氟离子选择电极在使用前,应在含10-4 moL/L F-或更低浓度的F-溶液中浸泡(活化)约30 min。
2、线性范围及能斯特斜率的测量
取5只100 mL容量瓶,用10.00 mL移液管移取0.100 mol/L F-标准溶液于第一只100 mL容量瓶中,加入TISAB 10 mL,去离子水稀释至标线,摇匀,配成1.00×10-2 mol/L F-溶液;在第二只100 mL容量瓶中,加入1.00×10-2 mol/L F-溶液10.00 mL和TISAB 10 mL,去离子水稀释至标线,摇匀,配成1.00×10-3 mol/L F-标准溶液。按上述方法依次配制1.00×10-6 ~1.00×10-4 mol/L F-标准溶液。
将适量F-标准溶液分别倒入5只塑料瓶烧杯中,放入磁性搅拌子,插入氟离子选择电极和饱和甘汞电极,连接好离子计,开启电磁搅拌器,由稀至浓分别进行测量,在仪器指针不再移动或数字显示在±1 mV内,读取电位值。再分别测定其他F-浓度溶液的电位值。
3、自来水样中氟含量的测定
(1)标准曲线法:准确吸取自来水样50.0 mL于100 mL容量瓶中,加入TISAB 10 mL,去离子水稀释至标线,摇匀。全部倒入一烘干的烧杯中,按上述实验方法测定电位值,记下数据。平行测定三次。
(2)标准加入法:在(2)测量后,加入1.00 mL 1.00×10-3 mol/L F-溶液后,再测定其电位值。
五、实验数据记录及处理
1、绘制标准曲线 绘制浓度对数与电势的关系曲线,确定该氟离子选择电极的线性范围及实际能斯特响应斜率。
氟离子浓度(mol/L) |
1.00×10-6 |
1.00×10-5 |
1.00×10-4 |
1.00×10-3 |
1.00×10-2 |
氟离子浓度的对数 |
|
|
|
|
|
电势(mV)1 |
|
|
|
|
|
电势(mV)2 |
|
|
|
|
|
电势(mV)3 |
|
|
|
|
|
平均电势(mV) |
|
|
|
|
|
2、测定水样的电势,并从标准曲线,查出被测试液F-浓度(cx),计算出试样中氟含量。
3、标准加入法测定水样电势,计算自来水中F-浓度的计算
注:求得三次平行测定水样中F-浓度平均值、测量的标准偏差、相对标准偏差。
六、实验注意事项
1、测量标准溶液时,浓度应由稀至浓。
2、绘制标准曲线时,测定一系列标准溶液后,应将电极清洗至原空白电位值,然后再测定未知液的电位。
3、测定过程中,更换溶液时,测量键应断开,以免损坏离子计。
4、测定过程中,搅拌溶液的速度应恒定。
5、氟离子选择电极的纯水电位与电极组成有关,也与所用纯水的质量有关,一般为300 mV左右。
6、氟离子电极暂不用时,宜于干放。
七、思考题
1、用氟离子选择电极法测定自来水中氟离子含量时,加入TISAB的组成和作用是什么?
2、标准曲线法和标准加入法各有何特点?比较本实验用这两种方法测得的结果是否相同,如果不同,说明其原因。